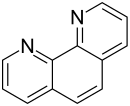
Phenanthrolin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenanthrolin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H8N2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 180,2 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Phenanthrolin (phen) ist formal ein Derivat des Phenanthrens, in dem zwei Methingruppen (CH-Gruppen) gegen Stickstoffatome ausgetauscht sind.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Phenanthrolin kann gemäß der Skraupschen Synthese durch Erhitzen von 8-Aminochinolin oder o-Phenylendiamin mit Glycerol, Nitrobenzol und konzentrierter Schwefelsäure dargestellt werden.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]In der Komplexchemie findet es als zweizähniger Ligand mit der Abkürzung phen Verwendung. Die bekanntesten Phenanthrolin-Komplexe sind Ferroin und Ferrocyphen, in denen Eisen(II)- bzw. Eisen(III)-Ionen die Zentralatome sind. Ferroin findet als Redoxindikator Verwendung.[1]
Die Schwermetallkomplexe des Phenanthrolins sind aufgrund ihrer Schwerlöslichkeit für quantitative Analysen geeignet, Methyl- und Phenyl-substituierte Derivate wie Bathocuproin und Bathophenanthrolin weisen eine noch höhere Selektivität auf.[1]
Phenanthrolin-Komplexe werden als Substrate zum Aufbau supramolekularer Systeme und zum Studium derer Eigenschaften, wie beispielsweise dem Elektronen- oder Photoelektronentransfer verwendet.[1]
In asymmetrischen homogen-katalysierten Reaktionen werden chirale Phenanthrolin-Derivate als Liganden eingesetzt.[1]
Biologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Photosynthese und Carboxypeptidasen werden von 1,10-Phenanthrolin gehemmt. Die Substanz und ihre Metallkomplexe interkalieren in die DNA. Da die Metallkomplexe als Metalloenzym-Analoga fungieren, dienen sie in der biochemischen Forschung als diagnostische Hilfsmittel.[1]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Eintrag zu 1,10-Phenanthrolin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. März 2012.
- ↑ a b c Eintrag zu 1,10-Phenanthrolin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu 1,10-phenanthroline im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.

